GPCR活性アッセイにはCa2+ アッセイ、cAMPアッセイ、βアレスチンアッセイ、レポータージーンアッセイなど様々な手法がありますが、共役するGαタンパク質のサブタイプにより使い分けねばならない、時間とコストが膨大に掛かるといった欠点がそれぞれにあり、決定打に欠けていました。網羅的で高感度高信頼性の当社アッセイ系はGPCR創薬の悩みを一気に解決します。
GPCRとは
GPCRは医薬品の重要な標的
Nat Rev Drug Discov 2017;16:829-842
Gタンパク質共役型受容体(GPCR)はヒトに約800種類あり、医学的、生物学的に極めて重要な細胞膜受容体群です(グラフ左)。嗅いや味を感知する感覚受容体が大半を占めるほか、血圧から血糖値、精神活動まで体の様々な機能を司る生理活性物質受容体が200種強、まだリガンドが知られていないオーファン受容体が約100種あります。
GPCRの中で生理活性物質受容体が医薬品の主な標的ですが、まだその一部しか承認薬の標的になっていません(グラフ右)。また最近の研究により、オーファン受容体や感覚受容体の中にも疾患に関わり医薬品の標的となり得るものが多くあることが分かってきました。
GPCR創薬の壁
Drug Browser. GPCRdb.
しかしながら、限られたGPCRでしか医薬品開発が進んでいません。図は標的薬の多い順にGPCRを下から並べたグラフです。一番下のDRD2は承認薬と開発中の化合物をあわせて80種以上ありますが、上に向かうにつれ急速に標的薬の数が減少し、100番目以降のGPCRに対する薬はほとんどありません。
比較的標的にしやすい一部のGPCR (low-hanging fruits) に対する医薬品開発、特に低分子薬の開発が進む一方、残りのGPCR (high-hanging fruits) の創薬にはなかなか手が届かない状況が続いていると言えます。
GPCR創薬の主な障壁のひとつは次の通り研究、創薬を支える優れたアッセイ系が存在しないことにあります。
- GPCRの結合実験は偽陽性、偽陰性が多くあてにならない。
- GPCR活性測定法の決定打がない。
- レポーターアッセイ以外の活性測定法は高コスト、煩雑、HTSへの拡張が困難。例)Western blotting
- レポーターアッセイで安定して活性を測定できるのは一部のGPCRのみ。特にG12/13、Gi/oシグナル検出の再現性、安定性が低い。
当社基盤技術
GPCR創薬の突破口
そこで当社はGPCR創薬の壁を打破し新薬開発を促進するため、既存試験法での活性評価が非常に困難だったGタンパク質サブタイプG12/13, Gi/oの壁を克服し、全GPCRの活性を測定できる画期的技術を開発しました。次特徴があります。
- 主要Gαタンパク質に共役する全てのGPCRに対応
- オーファン受容体の活性評価も現実的に可能
- 作動薬、拮抗薬、逆作動薬、 PAM、NAMを同定可能
- 業界最大規模313種のヒトGPCRの取り揃え
- これまでになく高感度、高S/B比
基盤技術構成要素
高感度で汎用的なアッセイ用細胞、 Gαタンパク質カクテル、全ヒトGPCRライブラリーから成ります。
試験用細胞
- Gタンパク質下流シグナルを増幅する人工遺伝子回路を細胞に組み込み、主要なGαタンパク質に共役するあらゆるGPCRに対して従来の活性測定法より格段に高感度、高S/B比
- G12/13共役受容体
- Gi/o共役受容体
- Gs共役受容体
- Gq共役受容体
- リガンド既知GPCRの99%で良好な応答を確認済( 210種中208種)
- 受容体チロシンキナーゼ等GPCR以外の細胞膜受容体に拡張可能
- 東京大学から国際特許出願中(公開番号 WO/2020/026979)。当社に仮専用実施権設定済
Gαタンパク質カクテル
Gαタンパク質3種のカクテル。試験用細胞に強制発現することにより、共役するGαタンパク質が不明なGPCRを活性評価可能にする、オーファン創薬の強力な武器。リガンド既知GPCRの95%で良好な応答を確認済。
網羅的GPCRライブラリー
感覚受容体を除くGPCRを網羅した業界最大級の受容体ライブラリー。ネイティブの遺伝子配列なので本来の受容体活性を評価できます。
- ヒト リガンド既知受容体 218、オーファン受容体 95、計 313受容体
- マウス リガンド既知受容体 212、オーファン受容体 64、計 276受容体
- 他種受容体に拡張中
アッセイ系検証
当社アッセイ系は多様なGPCRに対し高感度で既存試験法と整合性のある結果を提供します。図は当社試験でヒトGPCR 116種の活性を求め、IUPHARに登録されているEC50ないし解離定数と比較したものです。様々な受容体の活性を幅広い濃度で評価できることがわかります。
代表的なGPCRを用い、以下の通り当社試験の感度、S/B比、再現性を評価しました。
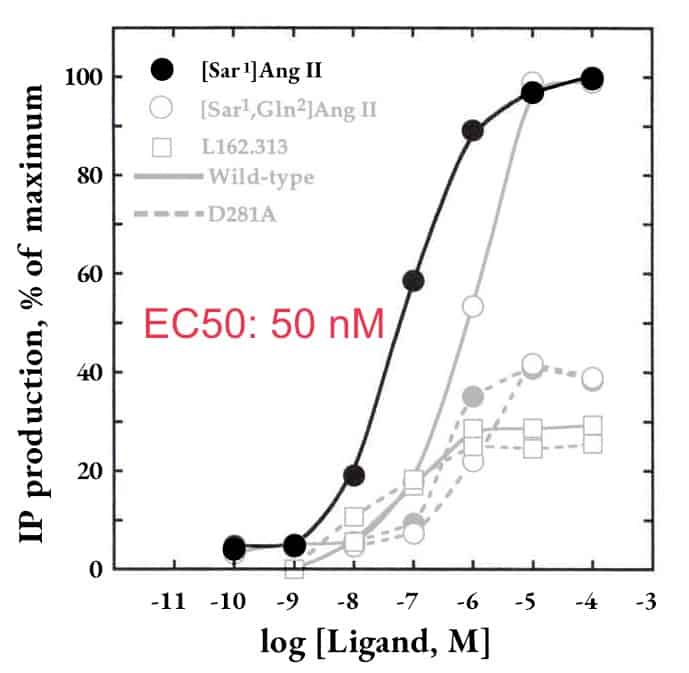
AGTR1:ペプチド性リガンド受容体の例
当社アッセイ系
結合実験
| Ligand | Ki (nM) ± s.e.m. | n |
|---|---|---|
| Sar1-angiotensin ⅠⅠ | 0.38 ± 0.07 | 3 |
| Sar1, Ala8-angiotensin ⅠⅠ | 0.43 ± 0.08 | 3 |
| Sar1, Ile8-angiotensin ⅠⅠ | 0.46 ± 0.03 | 3 |
| Ile7-angiotensin ⅠⅠⅠ | 1.1 ± 0.3 | 3 |
| Angiotensin ⅠⅠ | 1.6 ± 0.2 | 3 |
| Angiotensin ⅠⅠⅠ | 5.4 ± 0.5 | 3 |
| Dup753 | 6.3 ± 0.9 | 3 |
| Angiotensin Ⅰ | 74 ± 12 | 3 |
| Arg8-vasopressin | >1,000 | 2 |
| Endothelin | >1,000 | 2 |
| PD123177 | >10,000 | 2 |
GPR91:低分子リガンド受容体の例
当社試験系で測定したGPR91のアゴニスト応答は、既存試験法の結果と整合性があり、感度が高いことが示されました。
当社アッセイ系
Ca2+アッセイ
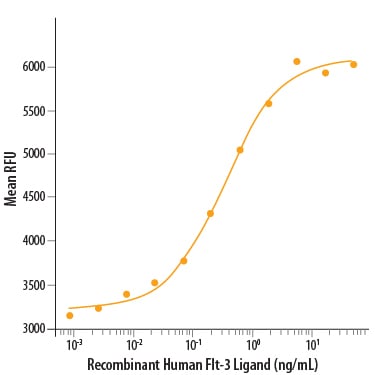
Flt3:受容体型チロシンキナーゼ (RTK) の例
GPCRのアッセイに用いたのと同じ試験細胞を使用し、GPCRと同じ方法でFlt3を一過性に強制発現しました。
当社アッセイ系

再現性
試行を繰り返しても同等な試験結果が得られることは、信頼性の上で非常に重要です。試験を繰り返した際の結果の一貫性を評価するため、β1アドレナリン受容体(ADRB1)に対するイソプロテレノールの濃度依存的活性について、異なる日に3回試験を行いました(図1, 表1)。それぞれの試験のEC50値が非常に近く、再現性が良好であることがわかります。
異なる日に実施した試験の結果を示す(平均 ± SEM, n = 4)。ADRB1に対するイソプロテレノールのアゴニスト活性を測定し、各試験のHill係数が等しくなることを拘束条件に結果をS字曲線にカーブフィットした。.
| 試験 | EC50 | Hill係数 |
| 1回目 | 33 nM | 2.8 |
| 2回目 | 36 nM | 2.8 |
| 3回目 | 31 nM | 2.8 |
| 全体 | 33 nM | 2.8 |
次に、試験実施者による結果のばらつきも評価しました。1型アンギオテンシン2受容体(AGTR1)のアゴニストモード(図2, 表2)、アンタゴニストモード(図3, 表3)のいずれにおいても、異なる試験実施者による結果がほぼ一致していることが示されました。
試験実施者2名による結果を示す(平均 ± SEM, n = 4)。AGTR1に対するアンギオテンシンIIのアゴニスト活性を測定し、各試験のHill係数が等しくなることを拘束条件に結果をS字曲線にカーブフィットした。
| 試験実施者 | EC50 | Hill係数 |
| 1 | 160 pM | 2.0 |
| 2 | 120 pM | 2.0 |
| 全体 | 140 pM | 2.0 |
試験実施者2名による結果を示す(平均 ± SEM, n = 4)。アンジオテンシンII存在下でAGTR1に対するバルサルタンのアンタゴニスト活性を測定し、各試験のHill係数が等しくなることを拘束条件にS字曲線にカーブフィットした。
| 試験実施者 | IC50 | Hill係数 |
| 1 | 2.1 nM | -1.4 |
| 2 | 2.4 nM | -1.4 |
| 全体 | 2.2 nM | -1.4 |
FAQ
人工遺伝子回路はノイズも増幅するのでないか?
刺激依存的な細胞内シグナルは2乗のオーダーで増幅される一方、ノイズは2倍程度にしか増幅されないよう、人工遺伝子回路が設計されています。実際、多くのGPCRで100倍以上に達する良好なS/B比が得られ、マイクロプレートウェル間のばらつきが小さい範囲に収まっています(「アッセイ系検証」参照)。
タンソーバイオサイエンスのアッセイはbiased agonismを評価できるか?
Biased agonismは標的組織におけるGαタンパク質サブタイプの発現パターンに依存しているので、in vivo試験系が必要です。
タンソーバイオサイエンスの試験系でオーファンGPCRは細胞膜に発現しているか?
オーファン受容体は陽性対照が存在しないので、当社アッセイ系の信頼性を保証する上で膜発現の確認が重要なことを認識しています。各オーファンGPCRで化合物スクリーニングを行い検証を進めているところです(「創薬事業」参照)。
ヒトGPCRを網羅していることは分かった。モデル動物の受容体はどうか?
マウスとラットのGPCRライブラリーを拡充中です。特定のGPCRについてご要望があれば優先的に対処し、約2週間でアッセイ体制を確立できます。
お問い合わせ
試験委託、見積依頼、共同研究のご提案、その他お問い合わせを賜ります。まずはアッセイ系について説明を受けたい、どのような試験デザインが可能か検討したい、といったご要望に応え、電話やウェブ会議での無料相談も行っています。以下のフォームかメールにてご連絡下さい。
試験委託の流れ
見積り依頼
ご希望、目的に適した試験と価格をご提案します。
発注
試験受委託契約を締結して頂きます。秘密保持契約も可能です。
化合物送付
当社宛に化合物をお送り頂きます。
報告書受領
試験開始から通常3週間後に結果報告書と生データを電子メールでお送りします。